不同溫度、pH值、光照及培養基對灰葡萄孢、黃曲霉菌株生長影響
摘要:對昆明市宜良縣玫瑰發病植株上分離獲得的1個灰葡萄孢菌株和1個昆明本地土壤中分離的黃曲霉菌株的生物學特性進行了分析。結果發現,昆明花卉致病灰葡萄孢菌株在4~25℃條件下均可生長,在25℃下生長速度最快,4℃時相對較慢,而在37℃時生長幾乎停止;黃曲霉在4、37℃時生長均受到明顯抑制,只在25℃時才能正常生長,表明黃曲霉菌株對溫度要更加敏感;pH值對于灰葡萄孢菌株的生長影響相對較小,灰葡萄孢在偏酸環境中生長較快;pH值對于黃曲霉菌株的生長影響較大,黃曲霉在中性及偏堿環境中生長明顯較快;光照對灰葡萄孢菌株生長的影響大于黃曲霉菌株,這可能和黃曲霉腐生于土壤,對光照刺激不敏感有關;2種菌株在不同培養基上的生長情況表明,兩者都可以利用葡萄糖、蔗糖為碳源生長,碳源對灰葡萄孢菌株生長幾乎沒有影響,而黃曲霉利用葡萄糖的能力要強于蔗糖,因此高葡萄糖環境可能更易于黃曲霉生長。
灰葡萄孢是灰霉病的病原菌,在農業生產上會造成嚴重的經濟損失,在氣候涼爽潮濕的地區為害尤為嚴重[1]。它是一類侵染性很強的以腐生為主的真菌,可以侵染200多種植物,其中包括云南省經常種植的花卉、葡萄、番茄、草莓、蔬菜等多種經濟作物。除了能引起田間損失,灰葡萄孢在果實的儲存和運輸中也會造成嚴重危害,使果實的儲存期變短、品質變差,帶來經濟損失[2-4]。
曲霉屬真菌是自然界分布最普遍的腐生菌之一,能使農產品變質、霉壞,造成重大的經濟損失[5]。據報道土壤中的曲霉資源較為豐富[6],劉艷梅等曾從甘肅省土壤中分離得到了7個種和3個變種的曲霉菌種[7]。作為貯藏物污染菌,黃曲霉是曲霉屬中非常常見的一個種類,其存在于土壤和各類動植物中。此前,有研究發現不同溫度對番茄灰葡萄孢孢子萌發的影響很大,其孢子的萌發適溫在15~25℃,最適溫度為20℃,30℃以上病害發展受到抑制。低溫有利于病菌產孢,產孢最適溫度為15℃[8]。此外,還有研究發現番茄灰葡萄孢喜偏酸性的環境,其在pH值3~11的范圍內都能生長,pH值為6時菌絲生長最快、產孢量最高[9-10]。黃曲霉是溫暖地區常見的占優勢的霉菌,菌落生長較快,培養10~14 d,其直徑可達6~7 cm[11]。
本研究以昆明本地分離得到的玫瑰致病灰葡萄孢菌株和土壤黃曲霉菌株為研究材料,分析其在不同溫度、pH值、光照及培養基等環境條件下生長情況,明確昆明本地致病灰葡萄孢、黃曲霉菌株的生物學特性,為了解昆明本地灰葡萄孢、黃曲霉菌株環境適應能力以及制定合理防治策略提供一定的理論參考。
1材料與方法
1.1灰葡萄孢、黃曲霉菌株的分離、純化與鑒定
供試灰葡萄孢菌株采集自昆明市宜良縣發病玫瑰,黃曲霉菌株取樣分離于昆明本地土壤。試驗用灰葡萄孢菌株采用組織分離法對病原菌分離,黃曲霉菌株則采用常規土壤微生物分離方法分離。此后,得到的各菌株采用已報道方法[12]進一步進行單孢分離,最終按《真菌鑒定手冊》進行鑒定。
1.2培養基的制備
本試驗共采用了3種培養基,培養基的成分如下。PDA培養基:去皮馬鈴薯40 g、葡萄糖4 g、瓊脂4 g、水200 mL;清水瓊脂培養基:瓊脂4 g、水200 mL;PSA培養基:去皮馬鈴薯40 g、蔗糖4 g、瓊脂4 g、水200 mL。
1.3溫度對菌絲生長的影響
用滅菌打孔器(直徑5 mm)取灰葡萄孢菌株、黃曲霉菌株菌落邊緣的菌塊,移植到PDA平板培養基中央,分別置于各處理溫度下的恒溫箱中培養,每24 h測量菌落直徑,每個處理重復3次,取平均值。
1.4 pH值對菌絲生長的影響
試驗設4個pH值梯度:5、6、7、8,將熔化好的PDA培養基用1 mol/L鹽酸或1 mol/L氫氧化鈉調節到所需pH值后(以精密試紙測定),倒平板備用。將灰葡萄孢菌株、黃曲霉菌株分別接種到PDA平板上活化后,用5 mm打孔器在菌落邊緣打孔,挑取菌片置于不同pH值的平板中央,在25℃下培養,每24 h測量菌落直徑,每個處理3次重復,取平均值。
1.5光照條件對菌絲生長的影響
試驗設計2個處理:全光照、全黑暗。將灰霉菌株、黃曲霉菌株接種到PDA平板上活化后,用5 mm打孔器在菌落邊緣打孔,挑取菌片置于PDA平板培養基中央,在試驗設定的條件下于25℃恒溫培養,每24 h測定菌落的直徑,每個處理3次重復,取平均值。
1.6不同培養基對菌絲生長的影響
培養基設3種處理:PDA培養基、清水瓊脂培養基、PSA培養基。將灰葡萄孢菌株、黃曲霉菌株接種至PDA平板上活化后,用5 mm打孔器在菌落邊緣打孔,挑取菌片置于平板中央,在設定的25℃下恒溫培養,每24 h測定菌落的直徑,每個處理3次重復,取平均值。
2結果與分析
2.1灰葡萄孢、黃曲霉菌株菌落的特征觀察
通過試驗觀察發現,灰葡萄孢菌株在培養基中生長時,菌絲初期為白色或淺灰色,呈現出致密的絨毛狀且緊挨培養基生長。菌絲產孢后,培養皿邊緣的菌絲顏色開始逐漸由白色向灰色或灰褐色轉變,菌絲生長繁茂但較短。
黃曲霉分離菌株培養初期為灰白色、扁平,之后出現放射狀溝紋,菌落顏色轉為黃至暗綠色,菌落背面無色至淡紅色。菌株頂囊大、球狀;小梗1~2層,布滿整個頂囊表面。菌絲為有隔菌絲,分生孢子球形或近似梨形,表面粗糙。
2.2灰葡萄孢、黃曲霉菌株生物學特性的比較研究
2.2.1溫度對菌絲生長的影響
在不同溫度處理下昆明地區分離的致病灰葡萄孢、土壤黃曲霉菌株的菌落生長速率有明顯的不同。2種真菌在溫度為4~25℃的區間內都能生長。灰葡萄孢在37℃時生長受到較大的抑制;而黃曲霉在4、37℃時生長受到抑制(圖1)。
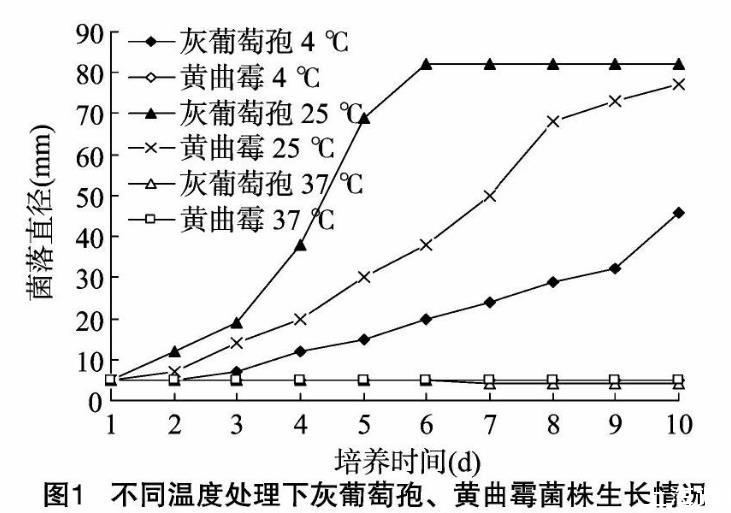
通過試驗分析表明,灰葡萄孢菌株菌絲雖然在4~37℃的溫度區間都可以生長,但是生長環境的溫度過高或過低都會對菌絲的生長產生較大的影響,而最佳生長溫度為25℃。溫度對黃曲霉菌株生長的影響明顯較灰葡萄孢大,過低或過高的溫度都會抑制黃曲霉生長。
2.2.2 pH值對菌絲生長的影響
圖2、圖3結果表明,昆明花卉致病灰葡萄孢、土壤黃曲霉菌株在pH值5~8的范圍內均可生長,但在不同pH值的培養基中生長速率具有一定的差異,而黃曲霉菌株的差異更為明顯。在pH值為6時,灰葡萄孢菌株生長速度最快,菌落直徑也最大。而黃曲霉菌株在pH值為7時生長速率最快,pH值為8時次之,pH值為5、6時則生長速率明顯慢得多。因此,pH值對于灰葡萄孢菌株的生長影響相對較小,與灰葡萄孢在偏酸環境中生長相對較快的報道一致。pH值對于黃曲霉菌株的生長影響較大,黃曲霉在中性及偏堿環境中生長明顯較快。
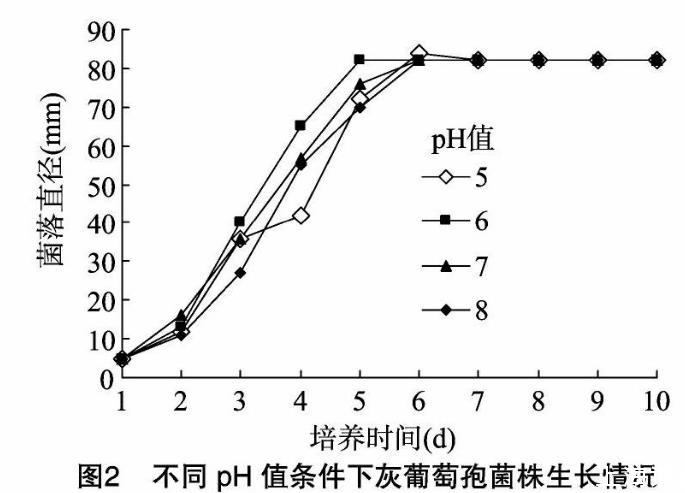
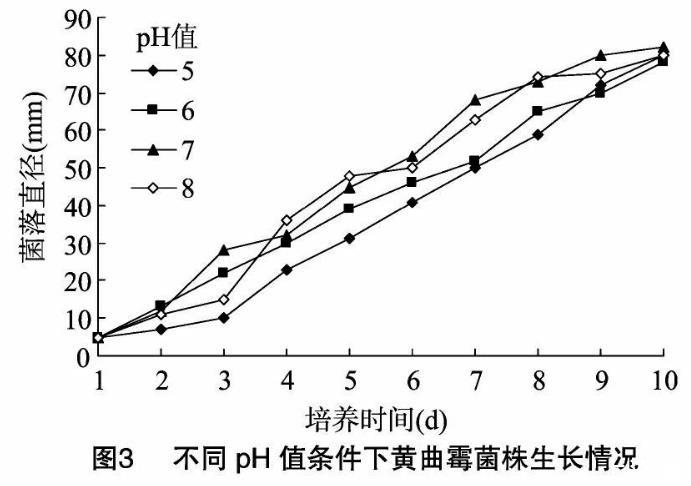
2.2.3光照對菌絲生長的影響
光照情況對昆明花卉致病灰葡萄孢菌株、土壤黃曲霉菌株生長也有一定的影響。無論是在全黑暗還是在全光照條件下,灰葡萄孢菌株的生長速率均快于黃曲霉;全黑暗條件下,灰葡萄孢菌株生長速率明顯要快于全黑暗條件;黃曲霉菌株則相反,黑暗培養時,菌株生長速率略快于全光照時的生長速率,但差異并不非常明顯(圖4)。由此可見,光照條件對灰葡萄孢菌株生長的影響要大于對黃曲霉菌株的影響。
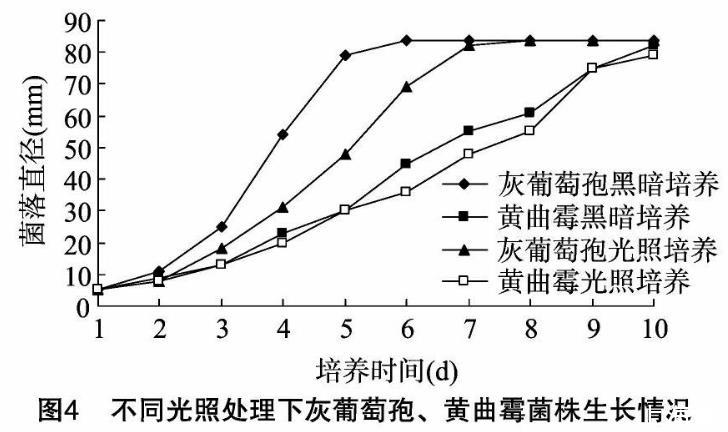
2.2.4不同培養基對菌絲生長的影響
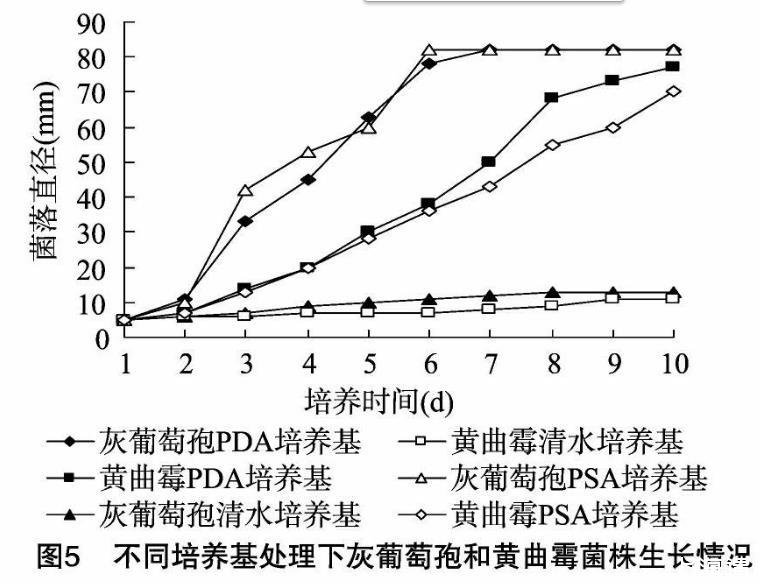
昆明花卉致病灰葡萄孢菌株、土壤黃曲霉菌株在PDA培養基、PSA培養基、清水培養基中均能生長。但無論在PDA還是PSA培養基中,灰葡萄孢菌株的生長速率都明顯快于黃曲霉,且灰葡萄孢在2種培養基內的生長速率沒有明顯差異,表明該菌株能有效利用葡萄糖、蔗糖作碳源正常生長。黃曲霉在PSA培養基內的生長速率要比在PDA培養基中的略慢,表明其利用葡萄糖的能力要強于蔗糖(圖5)。與預期一樣,在無額外碳源的清水培養基中,2個菌株的生長速率都非常緩慢,明顯無法正常生長。
3討論
灰葡萄孢適應性較強,是薔薇科花卉常見的一種致病真菌。黃曲霉是一種常見土壤腐生真菌,由于其分泌的毒素對人體有一定危害,在農業生產中受到了較高的關注。溫度試驗表明,昆明花卉致病灰葡萄孢菌株在4~37℃下均可生長,但在25℃下生長速度最快,4℃時相對較慢,在37℃時生長幾乎停止;而黃曲霉在4、37℃時生長均受到明顯抑制,只在25℃時正常生長,表明黃曲霉菌株對溫度要更加敏感。因此,陰冷的天氣最有利于玫瑰致病灰葡萄孢菌株的生長。昆明市每年春夏雨季氣溫在25℃左右時,都是監測玫瑰灰霉病的關鍵時期;當氣溫高于30℃以上時,可相對減少對灰葡萄孢病害的監測。
此外,試驗還發現,在pH值為5~8時,灰葡萄孢、黃曲霉菌株都可以生長,但pH值對于灰葡萄孢菌株的生長影響相對較小,灰葡萄孢在偏酸環境中生長相對較快。pH值對于黃曲霉菌株的生長影響較大,黃曲霉在中性及偏堿環境中生長明顯較快,這表明2種真菌在適應微環境的酸堿度上還是有明顯差異。另外,光照對灰葡萄孢菌株生長的影響要大于黃曲霉菌株,這可能和黃曲霉腐生于土壤,對光照刺激不敏感有關。培養基試驗表明,2種真菌都可以利用葡萄糖、蔗糖為碳源生長,但2種碳源差異對灰葡萄孢菌株幾乎沒有影響,黃曲霉利用葡萄糖的能力要強于蔗糖,因此高葡萄糖環境可能更易于黃曲霉生長。
相關新聞推薦
1、單一外源微生物的生長繁殖情況研究——誘變菌B38的生長曲線繪制
2、基于MALDI-TOF微生物質譜菌種快速鑒定技術,助力微生物鑒定和污染溯源調查
3、短梗霉素A對植物病原真菌灰葡萄孢菌AUR 1基因的抑制生長機理(一)
