磷濃度對海水鈍頂螺旋藻生長和預采收的影響(一)
螺旋藻(Spirulina)或節旋藻(Arthrospira)為藍藻門(Cyanophyta)、段殖藻目(Hormogonales)、顫藻科(Oscillatoriaceae)、螺旋藻屬(Spirulina)或節旋藻屬(Arthrospira)的藻類。螺旋藻是目前蛋白質含量最高的食品資源[1],同時,螺旋藻還富含功能獨特的活性多糖、藻藍蛋白、γ-亞麻酸等生物活性物質,在食品、醫藥保健、化妝品及飼料等領域得以廣泛應用[2]。研究表明,螺旋藻多糖對HIV病毒、丙肝病毒等多種病毒具有抑制作用[3],而且其在抗腫瘤、抗氧化[4]、免疫調節、降血糖血脂以及修復DNA損傷等方面也表現出了良好的功效[5-6]。螺旋藻還含有豐富的藻藍蛋白,藻藍蛋白已被證實具有顯著的抗癌、抗炎癥等多種生物活性[7],同時還能作為食用色素應用于食品行業[8]。γ-亞麻酸對心血管疾病具有良好預防作用,而且是合成前列腺素E1的前體物質[9]。
螺旋藻產業在國際上興起于20世紀80年代初,我國于90年代中期已成為國際上最大的螺旋藻產業國[10]。利用天然海水培養螺旋藻,可顯著節約淡水資源,同時可利用灘涂、鹽堿地等環境進行培養,有效緩解農用耕地日趨緊張的問題,而海水中含有大量營養元素,可大幅度降低螺旋藻培養的肥料成本。長期以來,海水螺旋藻的研究得到全世界的普遍關注,但目前大多僅停留在實驗室藻種選育階段。本實驗室于20世紀80年代末至90年代初在國際上率先建立了全海水的螺旋藻產業化生產技術,并與企業合作成功實現了海水螺旋藻的產業化,與傳統淡水螺旋藻養殖相比,其品質得以顯著提高[11-12]。
磷是調節細胞生長和代謝的必需營養因子之一,在大多數細胞過程中起著不可或缺的作用,特別是涉及能量轉移、信號轉導、高分子生物合成、光合作用和呼吸的過程[13]。研究表明磷元素對許多藻類脂質[14-15]、蛋白質[16]和多糖[17-18]的積累具有顯著影響。螺旋藻的主要成分及其含量可以通過多種培養條件來控制,如氮濃度[19]、光照強度[20]和溫度[21]。有關氮源、溫度和光照對螺旋藻的生長、代謝產物影響研究十分廣泛,但磷源濃度對螺旋藻生長代謝影響的研究還很少,僅見2篇文獻對淡水螺旋藻的主要生化組分[22]和脂類積累[23]影響的研究。對于磷濃度對海水螺旋藻生物量生產和生化組成的影響,尚未見報道。因此,研究磷對海水螺旋藻生長和生化組成的影響對海水螺旋藻主要高值化產物生產以及海水螺旋藻產業具有重要的指導意義。本研究首次開展不同磷源濃度的海水螺旋藻培養實驗,系統分析磷源濃度對海水螺旋藻生長及生化組成的影響規律,為通過磷調節來提高螺旋藻主要產物的產量、提升螺旋藻品質奠定理論基礎。
1材料與方法
1.1材料
1.1.1藻株及保存條件海水鈍頂螺旋藻(Spirulina Platensis)藻種,由中國科學院南海海洋研究所海藻資源與生物技術實驗室提供。
藻種保存條件:培養溫度為25±1℃,熒光燈提供光源,培養光強為49-57μmol·photons m-2·s-1,光暗周期為12 h∶12 h。
1.1.2實驗設計本實驗以改良的Zarrouk海水培養基為基礎培養基,其組成為:5 g/L NaHCO3,0.5 g/L NaNO3,0.01 g/L FeSO4·7H2O,0.08 g/L Na2EDTA,1 mL/L A5solution,以天然海水為基質配制而成。通過補加去離子水將鹽度控制在28±1‰。K2HPO4·3H2O為磷源,加入不同的磷源濃度(終濃度分別為0.005、0.01、0.02,0.03和0.04 g/L),接種于500 mL錐形瓶,于溫度為25℃,光強為49-57μmol·photons m-2·s-1條件下,靜置培養,每天定時搖瓶6次。培養結束后(培養周期10 d),離心收集藻泥,去離子水多次清洗,真空冷凍干燥獲得凍干粉,用于總糖、水溶性多糖、蛋白質、藻藍蛋白、光合色素總脂以及脂肪酸含量的測定。
1.2方法
1.2.1生物質濃度的測定利用干重法進行測定。取一定量的藻液,用預先在80℃烘箱中烘干至恒重的混合纖維濾膜(0.45μm)進行抽濾,再將有藻細胞的濾膜放置在80℃烘箱烘至恒重,用減差法得到微藻細胞干重。每個樣品重復3次計算平均值。
1.2.2總糖的提取及測定取10 mg藻粉,加入5 mL 0.5 mol/L H2SO4,于80℃水浴攪拌0.5 h,8 000 r/min離心10 min,收集上清液。反復抽提3次,合并上清后定容到50 mL,得到總糖提取液;總糖含量的測定采用苯酚-硫酸法[24]。
1.2.3水溶性多糖提取及測定取50 mg藻粉溶于水,超聲破壞細胞結構后,70℃熱水浸提4 h,8 000 r/min離心10 min收集上清。反復抽提4次,合并上清并定容至50 mL得到水溶性多糖提取液;水溶糖含量通過苯酚-硫酸法測定。
1.2.4胞壁多糖及總多糖的測定取上述提取水溶性多糖后所得藻渣,加入5 mL 0.5 mol/L H2SO4,于80℃水浴攪拌0.5 h,8 000 r/min離心10 min,收集上清液。反復抽提3次,合并上清后定容到50 mL,得到胞壁多糖提取液[25];采用苯酚-硫酸法測定其含量。
1.2.5蛋白質含量的測定采用半自動凱氏定氮儀測定總蛋白質含量,以蛋白質的F值為6.25計算。
1.2.6藻膽蛋白的測定采用改良的Sigelman和Kycia法提取藻膽蛋白,分光光度法測定藻藍蛋白、異藻藍蛋白含量[26]。
1.2.7脂溶性光合色素測定取10 mg藻粉,置于10 mL玻璃離心管中,加入5 mL丙酮,避光冰浴攪拌提取1-2 d,直至藻體變白,3 000 r/min離心10 min收集上清得到色素提取液。采用分光光度法在662 nm、645 nm和470 nm下測定葉綠素a、總類胡蘿卜素含量[27-28],由下列公式計算:
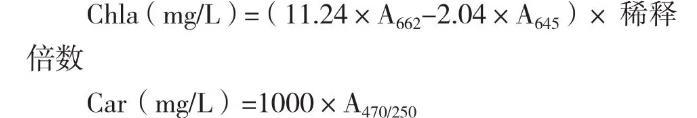
色素含量(%DW)=(色素質量濃度算×提取液體積)/藻體干重
1.2.8總脂的測定與分級總脂的提取與含量的測定采取改良的Khozin-Goldberg方法[29]。
1.2.9脂肪酸組成的測定稱取25 mg凍干藻粉于10 mL玻璃離心管中,加入2 mL 2%H2SO4無水甲醇:甲苯(9∶1,V∶V),充入氮氣后,用80℃水溶攪拌1 h,再依次加入1 mL去離子水和1 mL正己烷,充分震蕩后3 500 r/min離心5 min,將上層有機相轉移至另一離心管中,氮氣吹干,再加入1 mL含有C17標準品的正己烷,并用孔徑為0.22μm的濾膜過濾至1.5 mL的小玻璃瓶中,最后利用氣相色譜儀測定脂肪酸。
1.2.10統計分析數據以平均值,最后利用氣相色譜SPSS13.0統計軟件進行方差分析,檢驗水平儀=0.05,P<0.05差異有統計學意義。使用Origin 8.1進行數據處理和圖表制作。
相關新聞推薦
1、藜麥和藍靛果酵母菌株篩選、培養、計數及混菌液態發酵工藝優化(三)
2、犬奇異變形桿菌及其噬菌體分離鑒定、生長曲線及藥敏試驗(二)
3、不同溫度和pH對白三葉草鏈格孢菌菌落生長的影響【實驗結果】
