茶樹根際細菌菌株P5菌株對花生種子的促生機制
植物根際促生菌(plant growth-promoting rizobacteria,PGPR)是指以定殖或自由附著的方式生活在植物根際的一類細菌總稱[1]。它能改變根際土壤的理化性質、提高根際土壤中對植物生長有利的營養元素的轉化[2],也可通過分泌鐵載體、有機酸、生物表面活性劑、植物生長激素等,直接或間接促進植物的生長[3]。不同植物根際分離到的促生菌菌株對相應植物的種子萌發可能具有一定的促進作用。從柳枝稷根莖中分離篩選到可分泌IAA的Pseudomonas和Rhizobium細菌菌株,接種后可以提高鹽脅迫下柳枝稷種子的發芽率,促進胚根和胚芽的生長[4]。從西藏黑青稞根際篩選到的4株菌株對青稞種子發芽促進作用顯著,但不同菌株影響有差異[5]。而從大豆種子中分離到的內生芽孢桿菌菌株,大部分均表現出促進大豆發芽的作用,其中促生作用最好的SN 10 E 1菌株為巨大芽孢桿菌[6]。也有報道表明促生作用并不僅僅局限在同種屬的植物中。
李青梅等發現,經膠質芽孢桿菌菌劑處理的黃瓜、番茄、茄子及辣椒等4種蔬菜種子的發芽率均高于對照,但對蔬菜幼苗根生長的影響因蔬菜種類不同而異[7]。而從油菜根際土壤中分離到的3株菌N-1、N-15、K-25可使桔梗種子的發芽率和幼苗莖長明顯高于對照,也證明從一種植物根際能分離到對另一種植物有促生作用的功能菌,促生菌在不同植物根際的分布和作用存在交叉現象[8]。
在前期研究中,本實驗室從茶樹根際分離篩選到4株細菌菌株,其中PseudomonashunanensisGD 3具有溶磷解鉀能力,AgrobacteriumradiobacterKKS-6-N 1菌株具有固氮能力,2個菌株對白菜、空心菜及莧菜具有促生作用[9-10]。P 5菌株是采集茶樹根際土壤、以阿須貝無氮培養基篩選獲得的1株細菌,具有一定的固氮效能,而其余的促生特性還未知。本研究擬通過P 5菌株與2株具優良促生性能的GD 3和KKS-6-N 1進行浸種試驗,比較不同菌株對辣椒和花生種子萌發的影響;并通過灌根處理盆栽花生幼苗,研究P 5菌株對花生根際土壤微生物功能的影響效應,從根本上解析P 5菌株的促生機制。
1材料
1.1供試菌株及材料
3株茶樹根際細菌菌株GD 3、KKS-6-N 1和P 5(未知種屬)均為本實驗室從不同環境茶樹根際土壤中分離獲得,保存于本實驗室。
1.2供試材料與土壤
供試花生及辣椒種子均為當地市售種子。土壤來源于貴州省貴陽市花溪區貴州大學南校區農田土壤(26°42′48″N,106°67′31″E),去除表面枯枝浮土后,采集距表面20~50 cm處土壤,過篩后用于盆栽試驗。
1.3培養基
LB培養基、高氏一號培養基及馬丁培養基按《微生物學實驗教程》[11],參考Mab等[12]的方法配制蛋白胨氨化培養基、吳翔等[13]的方法配制阿須貝氏無氮培養基,NBRIP培養基參考Nautiyal等[14]的方法,亞歷山大硅酸鹽培養基參考何琳燕等[15]的方法。
2方法
2.1菌種的活化及菌液的制備
將保存于-80℃超低溫冰箱中的GD 3、KKS-6-N 1和P 5菌液取出適量,接種于LB培養基中,于30℃恒溫搖床中,150 r·min-1振蕩培養過夜活化;翌日取活化的菌液再次轉接于LB培養基中,相同條件下培養24 h,菌液測定OD600值,以無菌LB調整該值為1.0備用。
2.2菌株浸種處理對辣椒種子萌發及盆栽試驗的影響
將辣椒種子置于3%次氯酸鈉溶液中進行表面消毒10 min,用蒸餾水反復清洗多次后,處理組的辣椒種子分別置于OD600值為1.0的3種菌液中浸種2 h,未處理組對照種子則置于LB培養基中;浸種完成后用無菌濾紙略微蘸干表面液體、置于鋪有被無菌水潤濕的無菌濾紙的培養皿中,于30℃恒溫培養箱中放置15 d,期間保持濾紙濕潤,統計辣椒種子的發芽率;之后移栽于裝有300 g土壤的育苗盆中進行盆栽試驗,整個試驗期間保持土壤濕潤,30 d后收獲測定植株生長指標。試驗設對照組、GD 3處理組、KKS-6-N 1處理組和P 5處理組,每組為25粒種子,重復3次;盆栽試驗時每組6株幼苗,重復3次。
2.3菌株浸種處理對花生種子萌發的影響
將花生種子置于20%過氧化氫溶液中進行表面消毒20 min,經蒸餾水反復清洗后浸泡6~12 h,以無菌濾紙略微蘸干后置于3種菌株的菌液中進行2 h浸種處理,對照種子則置于LB培養基中;待浸種完成后,置于鋪有濾紙的培養皿中,30℃恒溫培養箱中放置3 d,統計花生種子的發芽率。種子試驗設計及處理同上。
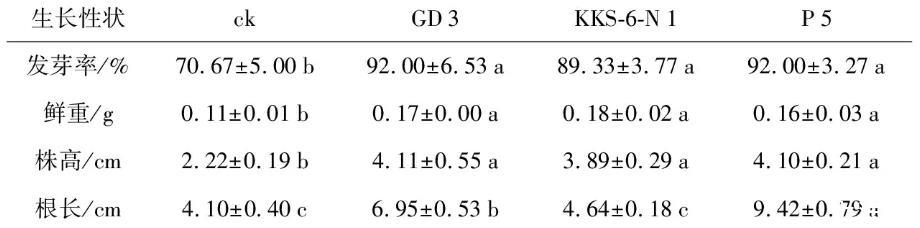
表1 3株茶樹根際細菌浸種對辣椒種子萌發及幼苗生長的影響
注:同一行不同小寫字母代表不同處理之間差異顯著(p<0.05)。下同。
2.4菌株灌根處理對花生幼苗生長的影響
將花生種子經過氧化氫消毒,蒸餾水清洗浸泡后,置于鋪有無菌濾紙的培養皿中,30℃條件下3 d待種子萌發后,選擇長勢相當的花生幼苗移栽于育苗盆中,以未接種菌株為對照,設置GD 3接種組、KKS-6-N 1接種組和P 5接種組,每2 d采用灌根法接種菌液,接種量為每次5 mL,對照組則用等量無菌LB培養基代替,每組均設6個重復,常規方式管理。30 d后測定花生株高、鮮重、根重及葉綠素含量等生長及生理指標,葉綠素含量采用Arnon法測定。
2.5 P 5菌株灌根對花生營養指標的影響
盆栽實驗30 d后,測定P 5接種組及對照組花生植株的營養指標,植株全氮含量測定采用凱氏定氮法,全磷含量測定采用鉬銻抗比色法,全鉀含量測定采用火焰分光光度法[16]進行。
2.6 P 5菌株灌根對花生根際土壤三大菌群及功能菌群的影響
30 d盆栽實驗后,利用抖根法收集P 5處理組的花生根際土壤,測定土壤三大菌群(細菌總數、放線菌總數及真菌總數),功能菌群數量的測定包括氨化細菌、固氮菌、溶磷菌及解鉀菌等4種類型。細菌、放線菌及真菌總數分別以LB固體培養基、高氏一號培養基及馬丁培養基測定,采用稀釋平板涂布法進行計數;以蛋白胨氨化培養基培養氨化細菌,采用最大近似值法(MPN,most probable numbers)測定;固氮菌、溶磷菌及解鉀菌分別以阿須貝無氮培養基、NBRIP培養基及亞歷山大硅酸鹽培養基培養,以稀釋涂布平板法計數。
2.7 P 5菌株灌根對花生根際土壤酶活性的影響
采集P 5灌根處理30 d的花生根際土壤進行土壤酶活性測定。土壤蔗糖酶酶活的測定采用硫代硫酸鈉滴定法,單位酶活是指每克干土所消耗的硫代硫酸鈉(0.05 mol·L-1)體積(mL·g-1)[17];過氧化氫酶酶活采用高錳酸鉀滴定法,單位酶活是指每克干土于20 min內所消耗的高錳酸鉀(0.1 mol·L-1)體積(mL·g-1);脲酶酶活的測定采用苯酚鈉-次氯酸鈉比色法,單位酶活是指37℃條件下、24 h處理后每克風干土壤中的氨氮含量(mg·g-1)[18];中性磷酸酶酶活是指每克干土經24 h處理后釋放酚的體積(mg·g-1),參照吳金水等[19]的方法進行測定。
2.8 P 5菌株的分子生物學鑒定及系統發育樹構建
P 5菌株的初步鑒定采用分子生物學方法進行。利用細菌DNA提取試劑盒抽提菌株的DNA,以細菌16 S rRNA基因的通用引物對27 F/1492 R進行PCR擴增,上、下游引物序列分別為27 F(5′-AGAGTTTGATCMTGGCTCAG-3′),1492 R(5′-TACGGYTACCTTGTTACGACTT-3′)[20]。PCR擴增體系及擴增條件參考王歡等[10]的方法。擴增產物經瓊脂糖凝膠電泳,檢測到有既定大小的條帶(約1 500 bp)送至上海英駿生物工程公司測序。獲得的核苷酸序列經NCBI網站上BLAST進行在線同源性比較,選擇相似性最高的結果進行分析。選取克雷伯氏菌屬的不同種菌株用于系統發育樹的構建,以PseudomonasmooreiRW 10 T(AM 293566)作外群。采用Clustal W 2進行多重序列比對、Mega 6.0構建系統發育樹,進行1 000次自展檢驗[21]。
2.9數據分析與處理
采用SPSS 20.0軟件,以LSR多重比較對數據進行分析。
