腸道菌群在帕金森病中的可能發病機制、防治現狀(一)
摘要
帕金森病是一種常見的神經退行性疾病,嚴重威脅著中老年人的健康,然而目前帕金森病的發病機制尚不完全明確。近年的研究顯示,腸道菌群在帕金森病的發生發展中發揮重要角色,腸道菌群及其代謝物通過微生物-腸-腦軸影響機體的腸道黏膜屏障、神經炎癥、內分泌等方面進而參與到帕金森病的發生發展中。腸道菌群可通過補充益生菌、糞菌移植、飲食調整、中醫藥干預等多種途徑進行調控,是帕金森病防治的重要靶點。本文對腸道菌群在帕金森病中的可能發病機制進行綜述,并進一步探討腸道菌群失調的防治現狀。
帕金森病(Parkinson’s disease,PD)是僅次于阿爾茨海默病的第二常見的神經退行性疾病,多發于65歲及以上人群,與衰老密切相關,流行病學研究數據表明我國此類人群的患病率達1.6%[1]。隨著我國人口老齡化進程的加速,PD患者數量急劇增加,這將會帶來嚴重的經濟和醫療負擔。PD的主要病理特征為α-突觸核蛋白(α-synuclein,α-syn)的異常聚集以及中腦黑質多巴胺能神經元的喪失,以運動癥狀和非運動癥狀為主要特征,嚴重影響患者的生活質量;PD運動癥狀包括運動遲緩、僵硬、異常姿勢和靜息性震顫等;患者還經常出現非運動癥狀,如便秘、焦慮、睡眠障礙、自主神經障礙等[2]。研究發現,大多數的PD患者存在胃腸道癥狀,如惡心、便秘、胃排空延遲等,其中約80%的PD患者會出現便秘,而且便秘癥狀比PD運動癥狀平均早10年或者更久[3]。近年來越來越多的研究表明,腸道菌群與PD密切相關,因此明確腸道菌群在PD中的作用機制,可能為PD的干預與治療提供新思路。
1腸道菌群與PD的相關性
1.1微生物-腸-腦軸
微生物-腸-腦軸(microbiome-gut-brain axis,MGBA)是將大腦與腸道功能整合的雙向信息交流系統,其中微生物在系統中扮演重要角色。腸道微生物通過神經系統、免疫系統和神經遞質等途徑與大腦進行交流[4-5]。腸道微生物可以直接刺激腸神經(enteric nervous system,ENS)傳入神經元,通過迷走神經(vagus nerve,VN)對腦發出信號。腸道微生物還可以通過免疫反應影響機體炎性因子水平進而影響中樞神經系統的功能。此外,腸道微生物能合成多巴胺(dopamine,DA)、5-羥色胺(5-hydroxytryptamine,5-HT)、γ-氨基丁酸(γ-aminobutyric acid,GABA)等多種神經遞質,通過ENS直接或間接地將信號發送給大腦。
1.2 PD患者和動物模型腸道菌群組成的變化
Mao等研究發現,PD患者糞便樣本中普雷沃氏菌屬(Prevotella)的豐度降低,與疾病嚴重程度呈負相關關系[6]。此外,Nishiwaki等研究表明,PD患者腸道菌群內分解腸道黏蛋白的阿克曼氏菌屬(Akkermansia)豐度升高,而產生短鏈脂肪酸的羅斯拜瑞氏菌屬(Roseburia)和棲糞桿菌屬(Faecalibacterium)豐度下降[7]。
在PD動物模型中同樣也存在著腸道菌群組成的改變。Gan等[8]對1-甲基-4-苯基-1,2,3,6-四氫吡啶(1-methyl-4-phe?nyl-1,2,3,6-tetrahydropyridine,MPTP)誘導的PD小鼠糞便研究顯示,厚壁菌門(Firmicutes)和疣微菌門(Verrucomicrobia)豐度增加,而擬桿菌門(Bacteroidetes)豐度降低。王玉等[9]研究發現,PD小鼠糞便中出現菌群失調,菌群多樣性升高且菌群組成發生明顯變化,厚壁菌門/擬桿菌門的比值增加,而且變形菌門(Proteobacteria)和放線菌門(Actinobacteria)豐度升高。此外,Zhao等研究發現,魚藤酮誘導的PD小鼠糞便中脫硫弧菌屬(Desulfovibrio)和阿克曼氏菌屬的相對豐度顯著增加[10]。更多關于PD患者和動物模型腸道菌群組成變化的研究總結見表1。以上結果表明,PD患者及PD動物模型的腸道菌群與健康的腸道菌群相比,在組成上存在明顯差異,而且菌群變化與PD的發病密切相關。
1.3腸道菌群與α-syn聚集
聚集性α-syn是神經元包涵體即路易小體(lewy bodies,LBs)和路易神經突(lewy neurites,LNs)的主要成分,是PD的病理標志[16]。α-syn的聚集可能始于腸道,經過迷走神經進入大腦,腸道菌群的改變是導致α-syn聚集的潛在因素。
在動物模型中,對過度表達α-syn的小鼠研究發現,具有正常腸道微生物菌群的小鼠腦內出現α-syn的異常聚集,而無菌小鼠并未出現以上改變;此外,將健康人群和PD患者的腸道微生物群分別移植到過表達α-syn的無菌小鼠腸道中,結果顯示,接受PD患者腸道微生物群移植的小鼠出現明顯的運動功能障礙,這表明PD患者腸道微生物的存在加劇了腸道中α-syn的病理變化[18]。以上研究表明,腸道菌群在α-syn的聚集中發揮重要作用。
2腸道菌群代謝產物與PD
2.1短鏈脂肪酸(short chain fatty acids,SCFAs)
SCFAs是腸道菌群的重要代謝產物之一,它的含量可以間接反映PD患者腸道菌群組成的變化。PD患者經常表現出胃腸功能障礙,而SCFAs可以調節腸神經系統活性,促進胃腸運動;與健康對照組相比,PD患者糞便中SCFAs含量以及產生SCFAs的細菌數量明顯減少,因此SCFAs濃度的改變可能是引起胃腸功能障礙的原因[19]。一項臨床研究表明,PD患者的低SCFAs與較差的認知能力和低身體質量指數(body mass index,BMI)顯著相關,較低的丁酸水平與較差的姿勢不穩定-步態障礙評分相關[20]。在魚藤酮誘導的PD小鼠中,丁酸鈉(sodium butyrate,NaB)的干預減少了多巴胺能神經元的丟失及α-syn的聚集,通過重塑腸道菌群的組成改善小鼠腸道功能障礙[21]。
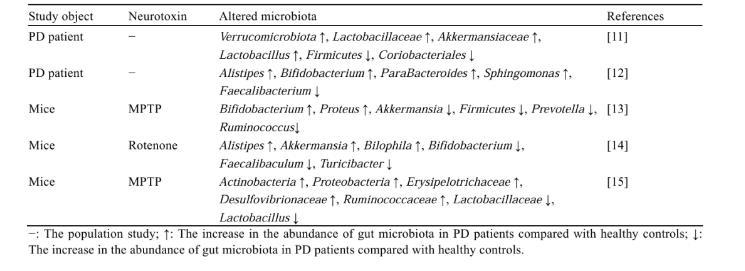
表1 PD患者和動物模型腸道菌群組成的變化
2.2膽汁酸(bile acids,BAs)
近年來,BAs成為微生物-腸-腦軸研究中的“明星分子”,它被證明是一種抗炎分子,在PD和阿爾茨海默病等神經退行性疾病中展現出治療潛力[22]。Nie等研究表明,伴有認知障礙的PD患者血清BAs有明顯改變,表現為鵝去氧膽酸(chenodeoxycholic acid,CDCA)、膽酸(cholic acid,CA)和熊脫氧膽酸(ursodeoxycholic acid,UDCA)水平的降低[23];在PD小鼠模型的血清中,牛磺熊脫氧膽酸(tauroursodeoxycholic acid,TUDCA)水平與對照組相比均顯著降低[24]。
2.3脂多糖(lipopolysaccharides,LPS)
LPS又稱為內毒素,是革蘭氏陰性菌外膜的主要成分,由脂質和多糖構成,被公認為是一種促炎因子,也可用來誘導PD動物模型。腸道菌群紊亂導致LPS增加,而LPS能夠特異性識別并結合Toll樣受體4(Toll-like receptor 4,TLR4),釋放促炎細胞因子引起全身炎癥[25]。Gorecki等研究表明,PD患者糞便中產生LPS的革蘭氏陰性菌γ-變形菌綱(Gammaproteobacteria)的豐度明顯高于健康對照組[26]。Yan等[12]研究發現,PD患者腸道中革蘭氏陰性菌與革蘭氏陽性菌的比值升高。
2.4氧化三甲胺(trimethylamine oxide,TMAO)
TMAO主要是通過腸道內的厚壁菌門和變形菌門等微生物對富含膽堿、甜菜堿、肉堿的食物進行代謝產生,它可以穿過血腦屏障,與神經炎癥密切相關[27]。臨床研究表明,PD患者血漿中TMAO水平明顯下降,這種較低水平的TMAO可作為PD早期診斷的生物標志物[28];另一項研究則發現,PD患者血漿中TMAO水平升高,并與疾病的嚴重程度和運動癥狀進展呈顯著正相關[29]。以上臨床研究結果表明,TMAO與PD之間存在較強的相關性,但具體結論并不一致。
綜上所述,腸道菌群代謝產物的含量變化與PD存在密切的相關性,它們通過調節腸道功能、影響神經炎癥、參與神經保護機制等方式參與到PD的進程中。因此,調節腸道菌群結構影響其代謝產物可能成為防治PD的新策略。
相關新聞推薦
2、大黃魚病原性哈維氏弧菌在試驗菌發酵上清液拮抗下的生長曲線
