瘢痕疙瘩MSCs生長曲線與發病機制研究(二)
2結果
2.1形態學特性原代分離培養的細胞初期大部分為小圓形細胞,培養24 h后大部分細胞死亡,只有少量細胞存活,且生長繁殖速度緩慢。細胞在經過1~2周的潛伏期后,細胞數迅速增多,形態呈梭形,放射狀生長,倒置顯微鏡下可見多個細胞克隆,繼續培養后細胞逐漸融合在一起,早期貼壁的細胞形態差異較大,有橢圓形、多角形和梭形等(圖1A)。隨著培養時間的延長,細胞形態逐漸變得均一,以長梭形為主。原代培養8~10 d后,改用低糖DMEM/(100 mL/L)得FBS培養基培養,經3~4 d培養后,細胞逐漸變的細長,分裂速度明顯加快(圖1B)。再改用低糖DMEM/(10 mL/L)FBS培養后,細胞形態變得更加均一,增殖速度更快,2~3 d就可以增殖2倍以上(圖1C)。后改用無血清干細胞培養基培養,細胞趨于穩定,為研究MSCs的各種生物學特性的最佳時期(圖1D)。
2.2細胞生物學標記物的檢測MSCs高表達CD29、CD44、CD73,低表達或不表達CD45,第3代細胞表面標記物表達的比例:CD29為99.99%,CD44為99.7%,CD45為0.69%,CD73為99.96%(圖2)。

圖1血清濃度逐步降低培養后的細胞形態
A:DMEM∶F12/(100 mL/L)FBS原代分離的細胞形態(8 d);B:低糖DMEM/(100 mL/L)FBS刺激后的細胞形態(14 d);C:低糖DMEM/(10 mL/L)FBS刺激后的細胞形態(17 d);D:無血清干細胞培養基中的細胞形態(19 d)。
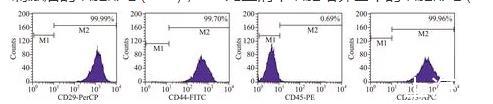
圖2流式細胞術檢測瘢痕疙瘩MSCs表面標志物的結果
2.3細胞生長曲線的繪制及特點第3代細胞生長曲線結果顯示,最初的2 d細胞生長緩慢,但從第3天開始細胞數量明顯增加,呈現對數生長,第7~8天以后細胞增殖變緩,形成一個平臺期(圖3)。

圖3瘢痕疙瘩MSCs的生長曲線
3討論
近年來國內外學者對瘢痕疙瘩的發病機制進行了深入研究,但其發病的實質仍未闡明,對MSCs的研究已成為瘢痕疙瘩發病機制研究的一個重要方向。IQBAL等[8]對瘢痕疙瘩皮損內和皮損外造血干細胞(haematopoietic stem cells,HSCs)和MSCs分布的研究發現,CD13+、CD29+、CD44+和CD90+的MSCs主要分布于皮損內,而CD34+、CD90+和CD117+的HSCs主要分布于皮損外。同時發現,在皮損內外還含有獨特的CD34+細胞,這提示瘢痕疙瘩為非造血干細胞提供了適宜的生長環境。AKINO等[9]研究發現,瘢痕疙瘩來源的成纖維細胞能夠誘導人MSCs向肌成纖維母細胞方向分化,這是終末分化成熟的成纖維細胞所不具備的屬性,而具有分化潛能的MSCs可能在瘢痕疙瘩的發生發展中發揮重要作用。
迄今為止,體外分離培養MSCs還沒有統一的方案,目前瘢痕疙瘩MSCs的分離主要借鑒正常皮膚MSCs的分離方法[6,10]。國內外一些學者也從瘢痕疙瘩中分離出了MSCs[11],但是分離的干細胞純度不高,混有成纖維細胞等雜質細胞,給進一步研究的結果判斷帶來一定的干擾,因此分離高純度的MSCs成為瘢痕疙瘩研究應首要解決的問題。
瘢痕疙瘩組織由于含有大量的膠原纖維,其質地比正常皮膚堅硬,在分離細胞時,首先將瘢痕疙瘩剪成小組織塊的過程比正常皮膚要困難,需要細心和技巧,同時用胰酶消化的時間要進行摸索,消化時間過短,細胞分離不出來,消化時間過長,細胞損傷嚴重,無法貼壁。本實驗經過探索選用2.5 g/L的胰蛋白酶37℃消化15 min后加含血清的培養液終止消化,可以達到較理想的效果。在細胞的后續培養中借鑒CARLSON[7]等關于小鼠心肌MSCs的培養方法,先用DMEM∶F12/(100 mL/L)FBS初步培養,再改用低糖DMEM/(100 mL/L)FBS培養,接著用低糖DMEM/(10 mL/L)FBS培養,最后用無血清的干細胞培養基培養。這種逐步降低血清濃度,形成血清的濃度梯度,在最初的培養中高濃度的血清有助于細胞貼壁和快速增殖,而隨著血清濃度的降低,直至無血清培養,不但干細胞的分化受到抑制,而且可能由于缺乏某些營養成分,雜細胞的生長也得到抑制,從而得到高純度的MSCs。此外,無血清干細胞培養基的細胞因子B27和FGF-2為MSCs生長所必須,而EGF和LIF則為非必須因子[6]。因此,無血清干細胞基礎培養基中需加入含B27和FGF-2等因子的添加劑。瘢痕疙瘩MSCs在培養過程中特別容易污染,因此預防細胞污染對干細胞能否培養成功尤為重要。在實驗過程中給干細胞培養基添加青霉素和鏈霉素,同時及時換液和傳代,注意操作過程中的細節,比如在培養細胞時將手進行徹底消毒,禁止說話等可防止細胞污染。
對于MSCs的鑒定目前也沒有統一的方法,迄今為止也沒有篩選到用于鑒定MSCs的特異標記分子,也沒有統一的命名[12-13],但不同來源的MSCs卻有一些共同的標準,如CD13、CD29、CD44、CD73、CD105和CD166陽性,CD11a、CD14、CD34和CD45陰性[14-16]。本實驗也采用多個表面標志組合進行鑒定,應用流式細胞術鑒定的結果表明瘢痕疙瘩來源的第3代纖維樣細胞均高表達CD29、CD44和CD73等MSCs表面標記物,低表達CD45等造血干細胞表面標記物。MSCs具有向成脂肪細胞、成骨細胞和成軟骨細胞等多向分化的能力,誘導分化實驗雖然能夠研究MSCs的多向分化潛能,但是不能提示細胞的純度。因此,我們直接用流式細胞術檢測細胞純度。同時細胞生長曲線分析表明,MSCs在最初2 d為生長緩慢的潛伏期,隨后細胞生長速度加快進入對數生長期,隨著細胞密度的增大,第7~8天形成一個平臺期。這說明本實驗分離培養的MSCs增殖及活力良好,可用于下一步的實驗研究。
本實驗通過總結各種已報道的干細胞的分離培養方法,吸取各自優點并加以改進,分離培養出了純度很高的瘢痕疙瘩MSCs,細胞形態為較均一的長梭形,與成纖維細胞類似,呈不規則放射狀生長。這為下一步關于瘢痕疙瘩發病機制的研究打下了良好的基礎。
